Glossaire
Electrolyse (Electrolysys)
Décomposition chimique de certaines substances sous l'effet d'un courant électrique.
L'électrolyse se réalise dans une cuve contenant un ELECTROLYTE (substance ou composé qui, à l'état liquide ou en solution, permet le passage du courant électrique par déplacement d'ions(1)) dans lequel sont plongées deux électrodes reliées aux bornes d'un générateur de courant continu.
(1) : atomes ayant perdu ou capté un ou plusieurs électrons.
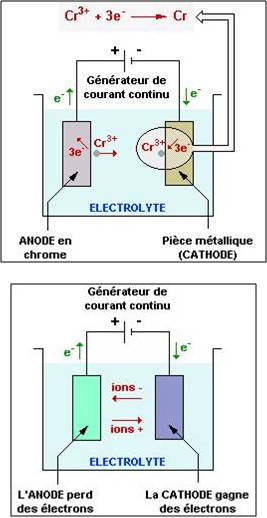
On appelle ANODE l'électrode reliée à la borne positive du générateur et CATHODE celle reliée à la borne négative du générateur.
L'ensemble constitue une cellule d'électrolyse.
Lors de l'électrolyse :
- l'ANODE est le siège d'une réaction d'OXYDATION (2) : avide d'électrons, elle se comporte comme un oxydant ;
- la CATHODE est le siège d'une réaction de RÉDUCTION (3) : source d'électrons, elle se comporte comme un réducteur.
(2) : l'OXYDATION est une réaction chimique au cours de laquelle un corps perd des électrons ; par exemple, la corrosion des métaux est due à une oxydation.
(3) : la RÉDUCTION est une réaction chimique inverse de l'oxydation, au cours de laquelle un corps réducteur cède des électrons à un corps oxydant
L'électrolyse a de nombreuses applications industrielles comme le chromage, la dorure, la galvanoplastie, la préparation du chlore, la fabrication de la soude à partir de sel marin. Par exemple, le chromage de pièce en acier se déroule ainsi :
- la pièce métallique constituant la CATHODE est plongée avec une ANODE en chrome dans une solution (l'ELECTROLYTE) contenant des ions de chrome (Cr3+) ;
- le générateur positionné entre l'anode et la cathode délivre un courant continu ;
- la pièce métallique gagne des électrons et attire les ions de chrome qui adhérent à sa surface.
Bases de connaissances utilisée par Airbus - Réalisation : CYBEL